
看著會場螢幕上出現一組跟家用冰箱差不多大小的機器,串接入培養箱,演講者Teresa Woodruff博士指著培養箱裡一個手掌大小的盒子說:「這是我們發明的女性生殖系統晶片組,裡面有卵巢、輸卵管、子宮、和週邊循環荷爾蒙系統。」在那時,第一次知道原來3D器官長這模樣,原來科幻片的場景如此真實靠近,而且正在發生。
卵子庫存量極低的女性,其實並非卵巢中完全沒有卵了,即使更年期,卵巢中還是存在一些原始濾泡,只是皆無法被活化發育,便是希望能藉著濾泡3D培養系統,讓這些原始濾泡在體外發育,進而得到成熟且有功能的卵子。3D培養是利用膠體創造出立體的培養環境,讓細胞長成需要的形狀,更進階可以搭配微流體,模擬體內血液及養分流動。首先利用動物實驗模式,圖一是Woodruff博士初步設計的濾泡培養系統,左為球狀膠體,中心即為小鼠原始濾泡,中為微流體裝置,右方則是微流體培養槽的放大,黑色小點即為一顆顆含有濾泡的球狀膠體。
(圖一) 濾泡3D培養

而Woodruff博士的團隊不只滿足於3D培養原始濾泡,他們希望這些體外培養濾泡的培養環境能和體內環境越接近越好,且希望能直接培養卵巢組織,於是將生殖系統中的相關器官,皆開發成類器官晶片,利用一小部分小鼠的卵巢、腦下垂體、肝臟、輸卵管、子宮、子宮頸各器官,串連為微流體培養晶片組,稱為「EVATAR」(圖二)。晶片組中的各種類器官,即使體外培養,仍能呈現與體內時相同功能,腦下垂體能夠釋放濾泡刺激激素(FSH)和促黃體生成激素(LH),讓濾泡生長成熟;輸卵管纖毛維持具有擺動運送卵子的功能。
(圖二) EVATAR串連示意圖及實體裝置


晶片組初步先以濾泡培養測試,可以看到一顆顆濾泡從較小的組織發育為較大的濾泡(圖三1、2),後續進展為卵巢切片培養,如圖三3、4,一開始皆為小顆濾泡,隨著培養天數逐漸長大,經由類腦下垂體FSH和LH的刺激,類卵巢也會反映出如同月經週期一般的雌激素(E2)及黃體素(P4)變化,以及加入hCG刺激後,可觀察到排卵現象(圖三7)!無論在濾泡培養或卵巢培養,卵子為正常成熟的卵子(圖三5),具有正常的細胞骨架(圖三6、8紅色部份)及紡錘絲染色體排列(圖三6、8藍色及綠色部分)。
Woodruff博士原本開發晶片組的用途是藥物開發及測試,不過對於卵巢早衰、或需接受癌症治療的女性(尤其是女童),有機會運用此技術得到可用卵子。因此創新發明,Woodruff博士獲邀致TEDx演講,EVATAR也獲Discover雜誌選為2017年百大發明之一。
(圖三) 濾泡及卵巢晶片中的排卵與成熟卵子

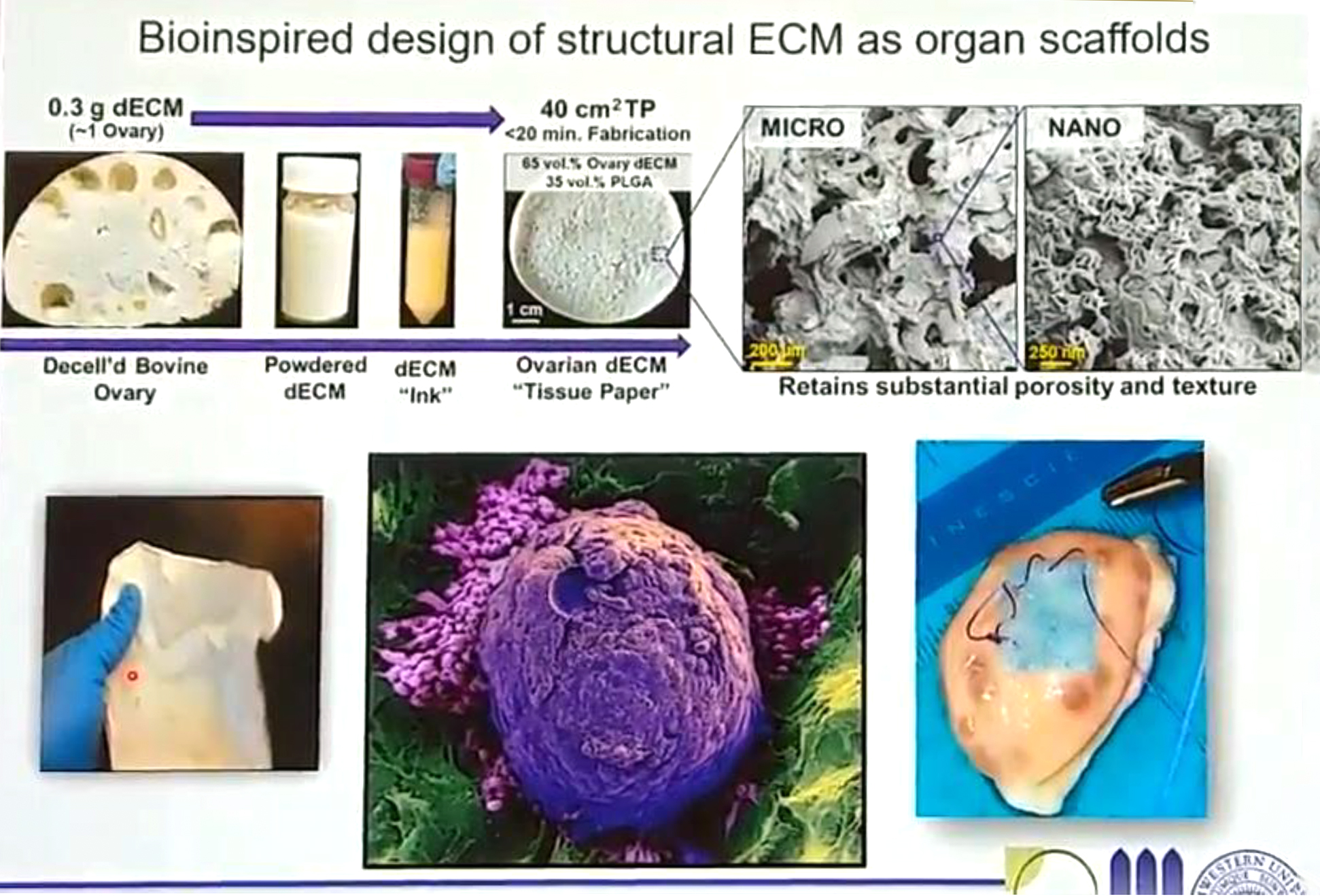
除了利用活體組織、器官的晶片組於體外培養卵子,Woodruff博士的團隊還致力於研發「人造卵巢」。從2015年到2017年,團隊為了得到人造卵巢的骨架,需要卵巢的細胞外基質,一開始只能利用去細胞化的牛卵巢切片充當,後續研究進展到可利用牛的去細胞卵巢粉末再加上一些化學材料,成功製成了「卵巢基質組織紙 Ovarian dECM “Tissue Paper”」(圖四),具有適當大小的孔洞和彈性,能夠讓濾泡在其中生長(圖四中下,紫色為濾泡、綠色為基質骨架)。他們把種入小鼠濾泡的組織紙移植回小鼠體內,發現濾泡可正常生長,小鼠體內也可測得雌激素(E2)及黃體素(P4)變化。
(圖四) 卵巢基質組織紙 (Ovarian dECM “Tissue Paper”)
2017年的另一個大進展,團隊運用3D列印技術,將合成的細胞外基質成分列印成網狀結構的骨架(圖五),更具生物安全性、對未來醫療的運用更廣。將種入小鼠濾泡的人造卵巢,移植到小鼠已切除卵巢的殘餘卵巢囊中,可看到如圖六所示,人造卵巢中有正常發育的濾泡(a)及成熟卵子(e),而被移植的小鼠,原本已失去生育能力,可恢復生理週期排卵,成功受孕產下後代(圖六h中綠色螢光者)。
(圖五) 3D列印卵巢骨架

(圖六) (a)人造卵巢中濾泡及(c)卵子、(h)人造卵巢小鼠後代

結合EVATAR以及人造卵巢技術,可將體外培養到一定程度的濾泡「種」到人造卵巢中,再移植回體內,有望恢復卵巢功能。雖然目前還在動物實驗階段,相信很快能進展到人體應用,例如罹癌女童無法像成人般進行促排凍卵,可先冷凍儲存部分卵巢再進行癌症治療,待日後將儲存之卵巢內原始濾泡利用EVATAR培養至初級或二級濾泡後,種進人造卵巢骨架進行自體移植,可保有自然生育能力。
生殖醫學的發展日新月異,藉由今年歐洲生殖醫學會進修的機會,讓我們看到不一樣的世界,不同的專家為了讓求子夫妻一圓家庭的美夢,各自在自己領域努力著。也許在不久的未來,沒有人需要苦於無精無卵,而試管嬰兒技術或許也和現今熟知的技術完全不同。拭目以待吧!
參考資料
- ESHRE 2019. Advanced tissue engineering to promote female fertility. T.K. Woodruff.
- A microfluidic culture model of the human reproductive tract and 28-day menstrual cycle. Nat Commun. 8:14584 (2017).
- A bioprosthetic ovary created using 3D printed microporous scaffolds restores ovarian function in sterilized mice. Nat Commun. 8:15261 (2017).














